
2021年1月19日,中国医学科学院基础医学研究所杜文静团队在Nature metabolism发表了“NADPH levels affect cellular epigenetic state by inhibitingHDAC3–Ncor complex”的论文。研究报道了NADPH可以作为信号分子参与表观遗传状态的调控,也揭示了HDAC3作为细胞内NADPH的感受器,通过感知细胞内NADPH的水平,调控组蛋白乙酰化和基因表达。
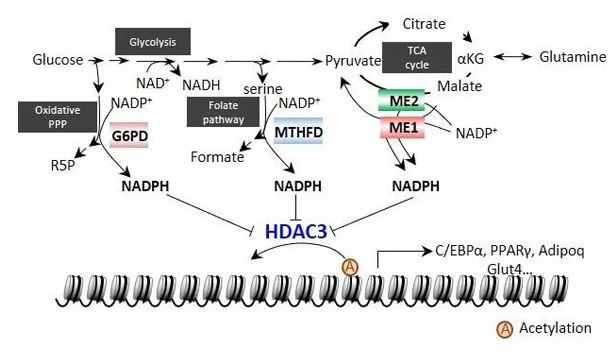
通常情况下,细胞内有三个主要的NADPH生成途径:磷酸戊糖途径、叶酸代谢途径和苹果酸酶代谢途径。长期以来的研究表明,NADPH作为细胞内关键的抗氧化分子,参与生物体内还原性生物合成以及氧化还原反应。但是细胞如何感知NADPH水平的变化以及NADPH本身的生理功能一直没有得到关注。该研究报道了NADPH在调节表观遗传状态和转录中的一种不依赖于其代谢角色的新功能。
研究人员通过敲低产生NADPH的关键代谢酶(ME1、ME2、G6PD或MTHFD2)来减少细胞内的NADPH水平,发现整体组蛋白乙酰化和转录水平被抑制;反之,过量表达这些代谢酶或添加NADPH可以显著增加组蛋白的乙酰化水平。为了弄清楚NADPH是如何影响组蛋白乙酰化,研究人员进行了体内及体外的分子机制研究。研究发现,NADPH可以抑制组蛋白去乙酰化酶HDAC3的活性,从而增加组蛋白乙酰化水平。令人意外的是,NADPH通过与Ins(1,4,5,6)P4竞争结合HDAC3,抑制HDAC3-Ncor复合物的形成,从而抑制了HDAC3的活性。因此,本研究揭示了NADPH可以作为信号分子参与表观遗传状态的调控,也揭示了HDAC3作为细胞内NADPH的感受器,通过感知细胞内NADPH的水平,调控组蛋白乙酰化和基因表达。本研究为深入理解NADPH的生理功能提供了研究方向。
本研究工作得到中国医学科学院医学与健康科技创新工程(2016-I2M-4-002)等项目的资助。基础医学研究所杜文静教授和合作者清华大学薛毅研究员为论文共同通讯作者,杜文静课题组的李薇硕士、2017级直博生寇俊婕和前清华大学博士后秦君英为论文的共同第一作者。
论文链接:https://www.nature.com/articles/s42255-020-00330-2
文图|基础医学研究所